«Eppur si muove!»: disse Galileo Galilei, quando fu costretto dalle circostanze a negare l’evidenza che fosse la Terra a muoversi intorno Sole.
È quello stesso atteggiamento remissivo a cui si costringe colui che venga contraddetto sull’evidenza della maturazione, intesa come quella serie di cambiamenti che i nostri liquidi per sigaretta elettronica subiscono nel tempo. Ma la maturazione esiste e ne parliamo in questo articolo.
Il fenomeno della maturazione esiste, ma non è causato da tutte quelle strampalate teorie che si sentono spesso, come la formazione di fantomatici reticoli tridimensionali, peraltro inspiegabili, mai dimostrati e che non darebbero ragione degli evidenti cambiamenti che l’aroma subisce nel tempo. Se dovessimo affidarci a teorie come queste, le molecole dovrebbero conservare le stesse caratteristiche e concentrazioni di partenza, ma non è così. Le molecole in questione reagiscono e si trasformano.
Ho sempre ritenuto difficile comprendere perché un aroma cambiasse di colore e di gusto solo una volta diluito nella base neutra, che è composta da glicole propilenico, glicerolo vegetale ed, eventualmente, acqua. Il mio limite più grosso era soprattutto spiegarmi il perché questi fenomeni non avvenissero già nell’estratto glicolico. Allora cominciai a cercare di dare un nome al complesso di reazioni che potevano avere luogo nel liquido pronto e sottoposi la questione ai soliti chimici.
Tutti furono concordi nel suggerirmi che le reazioni responsabili fossero quelle studiate da Louis Camille Maillard, chimico francese vissuto a cavallo tra l’800 e il ‘900, da cui prende il nome la reazione di Maillard, che spiega i motivi dell’imbrunimento e del cambiamento di sapore dei prodotti da forno nel corso della cottura, mutamenti molto simili a quelli osservati nei nostri liquidi in via di maturazione.
La reazione di Maillard spiega che il cambiamento di colore e di gusto che occorre al pane durante la sua cottura è dovuto ad una serie di reazioni chimiche che coinvolgono gli zuccheri riducenti e gli amminoacidi delle proteine. Semplificando molto le cose, nelle prime fasi di questa catena di reazioni si formano molecole note come intermedi di Amadori-Heyns e composti di natura aldeidica, chetonica, pirazinica, pirimidinica, ossazzolica e tiazolica, che sono responsabili del gusto tipico di crosta di pane. Dalla successiva condensazione di queste molecole, promossa dalla temperatura di cottura, si formano i composti che imbruniscono il prodotto da forno a fine cottura. La stessa reazione avviene in altre preparazioni culinarie, come nella cottura della carne ai ferri, al forno ed alla brace.

Riportando la novità all’amico e compagno di estrazioni Norberto Gallo, appresi che alcune analisi che stava facendo condurre in un laboratorio chimico universitario sui liquidi da estratto di tabacco stavano dando risultati che potevano avvalorare tale ipotesi, tanto che, anche in quel contesto accademico, il sospetto che si stava prefigurando fu lo stesso. In particolare, i rilievi strumentali stavano evidenziando un progressivo consumo di zuccheri riducenti ed aminoacidi, accompagnato dalla formazione di nuovi composti assenti nell’aroma di partenza.
Tuttavia, dovevo risolvere un problema: se la reazione di Maillard avviene tipicamente sopra i 140°C ed è favorita dal pH basico, come fa ad avere luogo con costanza nei nostri liquidi conservati a temperatura ambiente e caratterizzati da un pH del tutto casuale?
Ampliando la ricerca, venni a conoscenza che almeno una parte della reazione di Maillard può avere luogo a basse temperature. Per esempio, alcuni formaggi, come il Cheddar, danno luogo alle fasi più precoci della reazione di Maillard nel corso della loro maturazione.
Restava ancora una questione da chiarire: perché la maturazione avviene solo dopo la preparazione del liquido pronto allo svapo?
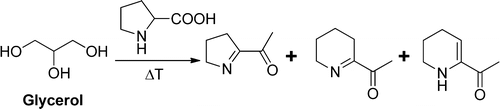
Nell’aroma organico concentrato sono presenti le molecole estratte dalla matrice organica, assieme a glicole propilenico e residui d’acqua. Per cui, l’unica molecola diversa che viene aggiunta nel liquido pronto è il glicerolo, quindi, feci ricadere i miei sospetti su quest’ultimo e orientai le mie ricerche di conseguenza.
Dopo una lunga ricerca, mi imbattei in un articolo scientifico che titolava “Glycerol, an underestimated flavor precursor in the Maillard reaction” di Candice Smarrito-Menozzi et al.
Mi sorprese. Nello svapo, avevo sempre ritenuto il glicerolo un solvente praticamente inerte, utilizzato principalmente per fare vapore, ma venivo a scoprire che poteva essere un precursore di aroma nella reazione di Maillard…
Quello studio, condotto nel 2013 presso la Nestlé Research Center di Losanna e pubblicato sul Journal of Agricultural and Food Chemistry, affermava che il glicerolo può agire come un reagente promotore della reazione di Maillard.
Come? Proprio Lui? Il glicerolo. Quella molecola che da sempre credevo di utilizzare esclusivamente perché da solo il glicole propilenico sarebbe stato troppo hittoso, secco, fluido, avrebbe saputo troppo di chimica e prodotto poco vapore. In poche parole, la causa poteva essere proprio quella Cenerentola delle basi neutre, di cui avrei potuto fare a meno, se il glicole propilenico fosse stato perfetto.
Approfondendo la questione, scoprii che altri studi avevano affrontato l’argomento, come il “Glycerol, another pyrazine precursor in the Maillard reaction” di Christoph Cerny e Renée Guntz-Dubini. In questo studio, Cerny e Dubini immisero del glicerolo marcato con 13C in una reazione di Maillard controllata, in cui furono posti a reagire alanina e fruttosio. Il reperimento del 13C nei numerosi prodotti finali della reazione di Maillard fu la prova che il glicerolo partecipava alle reazioni donando carbonio e non semplicemente influenzando la water activity, come precedentemente postulato in alcuni studi di Mustapha et al.
Prima ancora di Cerny e Dubini, il gruppo di lavoro di Wolfson aveva promosso il glicerolo da semplice solvente a reagente. Il gruppo di lavoro scoprì che il glicerolo poteva donare ed accettare idrogeno, oscillando dalla sua forma di partenza a quella di diidrossiacetone (DHA). Il DHA, tanto per intenderci, è il responsabile della reazione di Maillard condotta sulla pelle dalle creme autoabbronzanti. Infatti, il DHA reagisce con la cheratina della pelle formando composti dal colore più bruno. Ma guarda un po’… Proprio quello che capita ai nostri liquidi con l’avanzare della maturazione.
La reazione è aiutata dal calore e questo spiegherebbe, almeno in parte, perché molti ritengono che i liquidi intiepiditi a bagnomaria maturano in poche ore, scurendosi visibilmente.
La reazione di Maillard spiegherebbe anche perché gli aromi ottenuti con tecniche estrattive diverse dalla macerazione semplice vengono venduti come agita e svapa. Prendendo come esempio la tecnica di estrazione ultrasuono-assistita, studi come “Effects of high-intensity ultrasound on Maillard reaction in a model system of d-xylose and l-lysine” di Hang Yu et al. hanno rilevato che le cavitazioni, generando nell’estratto milioni di microzone riscaldate, promuovono la reazione di Maillard, già durante la fase di estrazione. Ed ecco spiegato perché chi estrae con gli ultrasuoni ha sempre avuto il forte sospetto che il prodotto ottenuto fosse adatto all’agita e svapa.
Andando verso la conclusione, vorrei portare il lettore verso un’ultima riflessione. Molti vapers concordano sul fatto che un aroma appena diluito sia perfettamente percepibile durante i primi giorni, per diventare meno intenso dopo qualche giorno e riemergere più intenso, strutturato e gradevole dopo qualche tempo. Anche qui, le ipotesi che si sono fatte strada sono molte, come la fantasiosa teoria che l’aroma venga “nascosto” in qualche modo da interazioni precarie con la base neutra, che si consoliderebbero col passare del tempo, svelando nuovamente l’aroma ai sensi. Anche in questo caso, nessuno ha mai fornito la minima prova.
Avrebbe sicuramente più senso considerare ancora una volta la reazione di Maillard. Infatti, la cascata di numerose reazioni, che avvengono in una sequenza temporale di durata variabile, potrebbe dare più senso a questa altalena organolettica. In tal caso, la velocità del raggiungimento dell’equilibrio dipenderebbe molto dal numero e dal tipo di molecole chiamate a reagire; in soldoni, dipenderebbe dal tipo di materiale estratto. A sostegno di questa teoria, non è un segreto che aromi più semplici, come quello di tabacco Virginia, maturano più in fretta, mentre aromi più strutturati, come quello di Latakia, tabacco ricco di componenti aggiuntivi derivanti dalla cura al fuoco di piante resinifere ed erbe aromatiche, richiedono tempi significativamente più lunghi.
In conclusione, forse da sola la reazione di Maillard non spiega del tutto i fenomeni che avvengono durante la maturazione dei nostri liquidi, ma certo un passo avanti lo abbiamo fatto e sappiamo che la maturazione è un fenomeno reale, che ha spiegazioni chimiche.
Presto potremo leggere i risultati degli studi portati avanti grazie all’amico Norberto e forse potremmo spaziare ulteriormente in questo affascinante argomento ed averne una visione più completa. Nel frattempo, restate sintonizzati.